Stand der SARS-CoV-2-Impfstoffentwicklung
Seit Beginn der COVID-19-Pandemie wurde weltweit große Hoffnung auf die Entwicklung – idealerweise mehrerer – wirksamer, sicherer und gut verträglicher Impfstoffe gegen das neue Coronavirus (SARS-CoV-2) gesetzt. Die entwickelten Pandemie-Impfstoffe sollen vor allem den Schutz von Risikopersonen für einen schweren Verlauf einer COVID-19-Erkrankung ermöglichen und idealerweise zur nachhaltigen Eindämmung des Virus beitragen.
Nach der Zulassung in der EU und der Verfügbarkeit erster Impfdosen wird seit dem 27.12.2020 in Deutschland gegen COVID-19 geimpft. Informationen zur COVID-19-Impfung und der weiterhin wichtigen Wahrnehmung von Standard-Impfungen gemäß Empfehlungen der Ständigen Impfkommission (STIKO) finden Sie hier.
Strategien der SARS-CoV-2-Impfstoffentwicklung
Der SARS-CoV-2-Impfstoffentwicklung liegen unterschiedliche Plattformen zu Grunde. Alle Strategien basieren auf dem Prinzip, unserem Immunsystem den abgeschwächten oder inaktivierten Erreger oder einzelne Bestandteile (sog. Antigene) des Erregers zu präsentieren, sodass eine Immunität gegenüber SARS-CoV-2 aufgebaut werden kann.
Zum einen werden bei der Impfstoffentwicklung gegen SARS-CoV-2 lang etablierte Technologien verwendet, für die es bereits zugelassene Impfstoffe gegen andere Erreger gibt (abgeschwächte Lebendimpfstoffe, inaktivierte oder proteinbasierte Totimpfstoffe). Die meisten Strategien nutzen aktuell jedoch Technologien, für welche zuvor noch keine (z.B. genbasierte DNA- oder RNA-Impfstoffe) oder nur wenige zugelassene Impfstoffe (Vektor-Impfstoffe gegen das Ebolavirus) zur Verfügung standen. Für diese gab es noch keine oder kaum Erfahrungen aus der breiten Anwendung.
In klinischen Studien muss untersucht werden bzw. wurde geprüft, ob und in welcher Dosierung ein Impfstoffkandidat in Erwachsenen und Älteren ausreichend wirksam und sicher ist.
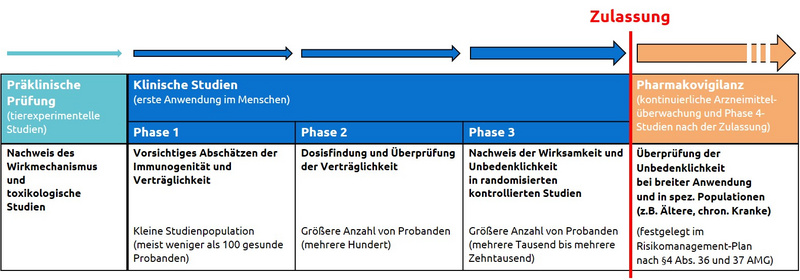
Das Entwicklungsprogramm eines Impfstoffs
Ausführliche Informationen zur Zulassung und klinischer Prüfung neuer Impfstoffe finden Sie hier.
Sicherheit im Fokus
Nach geltendem Arzneimittelrecht erhält ein Impfstoff nur dann eine Zulassung, wenn seine pharmazeutische Qualität, Wirksamkeit und Unbedenklichkeit nachgewiesen sind. Den Nachweis darüber müssen die Hersteller in einem umfassenden Zulassungsverfahren in einer Reihe von vorklinischen Untersuchungen (z.B. tierexperimentellen Studien) und klinischen Prüfungen (Phase 1- bis 3-Studien, erste Anwendung im Menschen) erbringen (siehe Abbildung). In Deutschland werden die wissenschaftlichen Belege durch das PEI geprüft, auf EU-Ebene durch europäische Zulassungsbehörden inkl. des PEI unter Regie der Europäischen Arzneimittelagentur EMA.
Auch nach erfolgter Zulassung wird die Sicherheit und Wirksamkeit der Impfstoffe weiter überwacht. Jede neu produzierte Impfstoffcharge muss, bevor sie auf den deutschen Markt kommt, nach einer unabhängigen Prüfung durch das PEI freigegeben werden (staatliche Chargenprüfung). Zudem sichert eine kontinuierliche Überwachung und Erfassung weiterer Daten im Rahmen der breiten Anwendung eine schnellstmögliche Erfassung von potenziellen Risiken. Diese sogenannte post-marketing Surveillance (Pharmakovigilanz/Phase 4-Studien) ist unerlässlich, um weitere Informationen zur Sicherheit des Impfstoffs (z.B. Auftreten sehr seltener unerwünschter Nebenwirkungen) in größeren und heterogeneren Bevölkerungsgruppen zu erhalten, die nicht in klinischen Prüfungen vor Zulassung untersucht wurden.
Im Rahmen der sogenannten Spontanerfassung von unerwünschten Wirkungen müssen dem PEI alle Verdachtsfälle von Impfkomplikationen gemeldet werden. So können zeitnah neue Signale detektiert und das Nutzen-Risiko-Profil der Impfstoffe kontinuierlich überwacht werden. Dabei ist jedoch zu beachten, dass auch Reaktionen in zeitlicher Nähe zu einer Impfung nicht unbedingt im ursächlichen Zusammenhang mit einer Impfung stehen müssen.
Das PEI berichtet kontinuierlich über die gemeldeten Verdachtsfälle von Nebenwirkungen und Impfkomplikationen im zeitlichen Zusammenhang mit der Impfung gegen COVID-19 in Sicherheitsberichten.
Darüber hinaus engagiert sich das PEI mit aktiven Pharmakovigilanz-Studien für eine hohe Impfstoffsicherheit.
Um die Verträglichkeit von COVID-19-Impfstoffen zeitnah und auf breiter Datenbasis zu erfassen, hat das PEI zudem die Smartphone-App SafeVac2.0 entwickelt. Mit dieser können Geimpfte digital Auskunft darüber geben, wie sie die Impfung vertragen haben. So können Teilnehmerinnen und Teilnehmer dieser Beobachtungsstudie aktiv dazu beitragen, weitere Erkenntnisse über COVID-19-Impfstoffe zu gewinnen. Weitere Informationen zur Smartphone-App SafeVac2.0 finden Sie hier.
Weiterführende Informationen:
(Auswahl)
- Informationen der WHO zu COVID-19-Impfstoffen
- Information des Vaccine Centre at the London School of Hygiene & Tropical Medicine über den zeitlichen Verlauf der einzelnen Impfstoffprojekte (englischsprachig; wird nicht mehr aktualisiert, letztes Update: 11.08.2022)
- Information des PEI über die Fakten und Antworten auf Fragen zur Impfstoffentwicklung gegen das Coronavirus SARS-CoV-2
- Artikel zur Impfstoffentwicklung im Deutschen Ärzteblatt vom 27.3.2020: Forschung mit geeinten Kräften